
Fosfatos, Arseniatos y Vanadatos; Sulfatos, Cromatos, Molibdatos y Wolframatos; Carbonatos, Nitratos y Boratos; Haluros

En esta vitrina encontraremos una colección sistemáticas de Haluros; Carbonatos, Nitratos y Boratos; Sulfatos, Cromatos, Molibdatos y Wolframatos; Fosfatos, Arseniatos y Vanadatos.
Contenido
En las dos baldas superiores se exponen ejemplares pertenecientes a Fosfatos, Arseniatos, Vanadatos, Sulfatos, Cromatos, Molibdatos y Wolframatos.
Fosfatos, Arseniatos y Vanadatos están formados por combinaciones de los complejos aniónicos tetraédricos (XO4)3- con cationes metálicos, donde X es P, As ó V (en estado de oxidación 5+) en coordinación tetraédrica. Los enlaces X-O son covalentes, mientras que la unión entre los grupos aniónicos y los cationes es de naturaleza electrostática. Son frecuentes la presencia de moléculas de agua y las sustituciones iónicas entre P, As y V en los minerales de esta clase, gracias a la similitud de sus radios iónicos. La mayor parte de estos minerales son rómbicos o monoclínicos.
Los Fosfatos son relativamente numerosos aunque sólo destaca el apatito por su abundancia relativa, en cuya estructura pueden entrar otros aniones adicionales como F-, Cl- y (OH)-. Los Arseniatos y Vanadatos más comunes son mimetita, vanadinita.
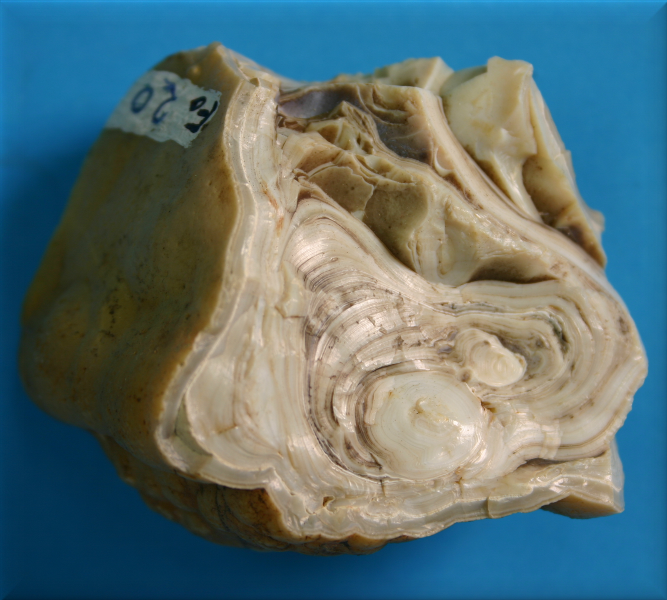 |
| Fosforita concrecionada de Peñaflor (Córdoba) |
Sulfatos, Cromatos, Molibdatos y Wolframatos son sales formadas por la unión de grupos aniónicos (XO4)2- con cationes metálicos, donde X es S, Cr, Mo ó W (en estado de oxidación 6+) en coordinación tetraédrica con el Oxígeno. Los enlaces X-O son covalentes, mientras que la unión entre los grupos aniónicos y los cationes es de naturaleza electrostática.
Los Sulfatos poseen frecuentemente baja simetría. Son relativamente blandos, con peso específico variable según el catión principal. Muchos son solubles en agua, excepto los que contienen cationes de gran radio (Ba, Sr, Pb).
 |
| Yeso con macla de San Andrés |
En los Molibdatos y Wolframatos los tetraedros están deformados debido al gran tamaño de los iones Mo y W. Son minerales de elevado peso específico, que se presentan frecuentemente bien cristalizados. Poseen gran variedad de coloraciones, hábitos, etc. Los wolframatos más comunes son: Wolframita y Scheelita. La Wulfenita es el molibdato más abundante.
 |
| Wulfenita de Chihuahua (México) |
Los Cromatos son un grupo reducido de minerales, muy escasos en la naturaleza. El mineral más abundante de este grupo es la Crocoita.
En la balda tercera nos encontramos con una representación de Carbonatos, Nitratos y Boratos.
Dentro de ellos están incluidas las sales oxigenadas en las que el oxígeno posee coordinación ternaria (a excepción de algunos boratos con coordinación tetraédrica). Están formados por grupos aniónicos de tipo XO3, donde X es C4+, N5+, B3+, respectivamente. El átomo central (X) está coordinado con tres oxígenos, con una disposición estructural triangular plana. Los enlaces X-O son covalentes, mientras que los enlaces que unen los grupos aniónicos con los metales son iónicos.
Los Carbonatos se caracterizan por cristalizar en sistemas de baja simetría, aunque también pueden ser hexagonales o trigonales. Entre sus cualidades están que generalmente son incoloros, excepto los que contienen metales de transición, y presentan brillo vítreo y una elevada birrefringencia. Son solubles en ácidos desprendiendo CO2 y produciendo efervescencia.
 |
| Cristales de Calcita |
Los Nitratos son estructuralmente semejantes a los carbonaros. Son muy solubles en agua y se descomponen en medio ácido con menos facilidad que los anteriores.
Los Boratos son poco frecuentes en la naturaleza pero tienen una gran diversidad mineralógica por su gran capacidad de polimerización, presentando características diferentes entre sí en cuanto a color y aspecto. Son relativamente blandos y presentan coloraciones blancas, grises o amarillentas.
En la balda inferior se encuentra la clase de los Haluros. Esta clase comprende compuestos halogenados de los metales, formados por iones halógenos electronegativos (especialmente F y Cl) con cationes metálicos, principalmente alcalinos y alcalino-térreos (Na, K, Ca, Mg), así como sus sales hidratadas y compuestos más complejos como los oxihalogenuros. Presentan estructuras cristalinas típicamente iónicas. Cuando los iones halógenos se combinan con cationes más pequeños y polarizados, como Al, Cu y Ag, se forman estructuras de simetría más baja, con enlaces covalentes. En este caso, el agua o el grupo hidróxilo (OH)- son componentes adicionales importantes.
Estos minerales cristalizan en su mayoría en el sistema cúbico, aunque también hay algunos rómbicos y monoclínicos. Se caracterizan por una dureza relativamente baja (los fluoruros son más duros que los cloruros), peso específico variable según el catión principal, y puntos de fusión de moderados a elevados. Algunos son solubles en agua y presentan distintas coloraciones en función de las impurezas presentes en su estructura y de los centros de color (defectos estructurales).
 |
| Fluorita del Cerro de los Santos (Córdoba) |