
En el rubí, Cr3+sustituye algunos de los iones Al3+ en la red de Al2O3 (corindón). Como el Cromo no forma parte de la composición del corindón, se dice que el rubí es una variedad. El campo cristalino alrededor de la impureza de Cromo hace que algunos niveles de energía cuantizados estén disponibles para los electrones desapareados. Éstos se presentan como niveles B, C y D. Sin embargo, existen unas reglas de selección que determinan que el nivel B no está disponible para excitación en este caso.
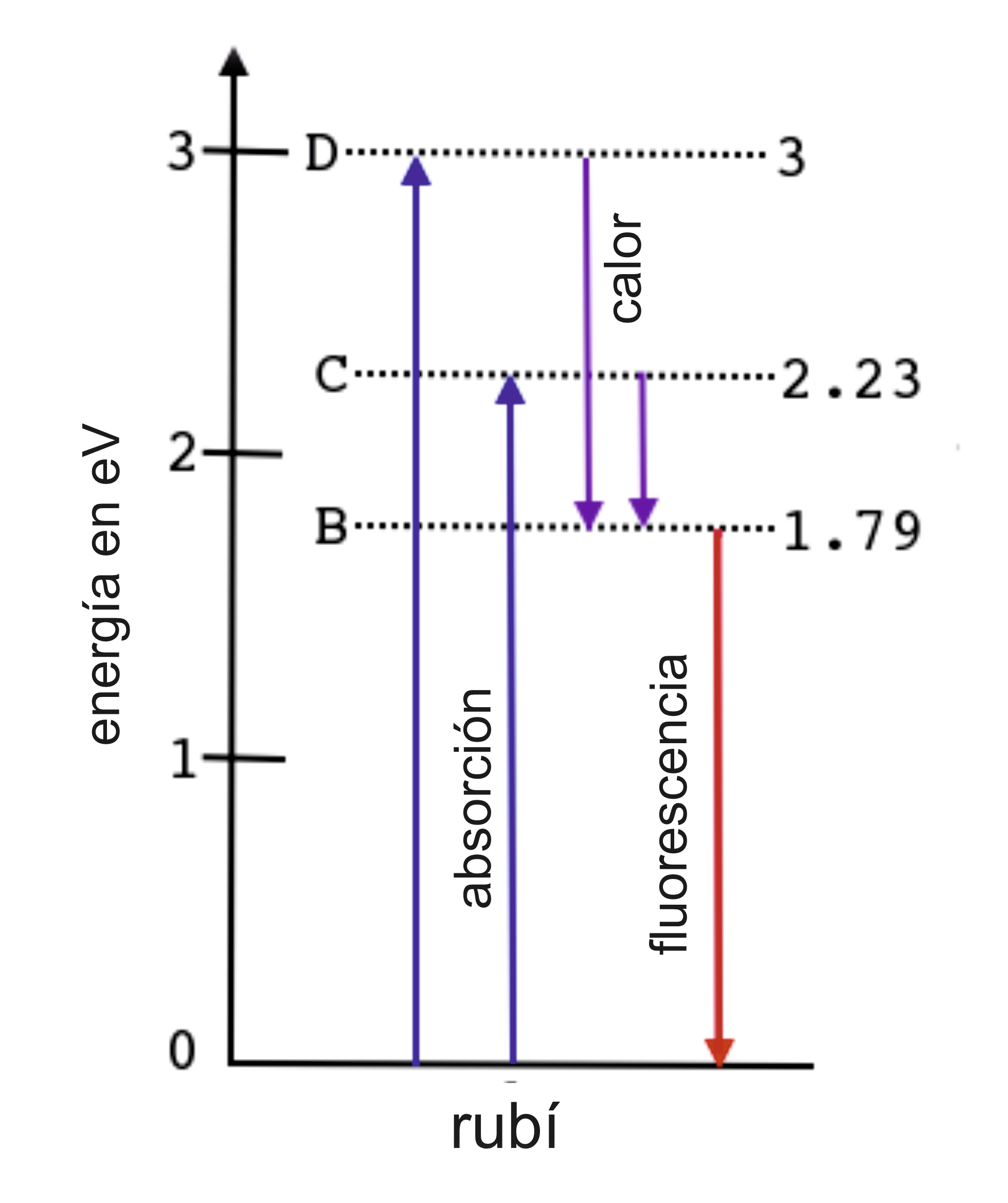
Los niveles C y D corresponden con energías de 2,23 eV (luz amarillo-verde) y 3 eV (luz violeta) respectivamente.
Esto significa que cuando la luz blanca entra en un rubí, la luz amarillo-verde y la violeta son absorbidas por los electrones desapareados, que ahora tienen suficiente energía para ser excitados a los niveles C o D.
Los colores residuales que no son absorbidos determinan el color rojo del rubí. Las mismas reglas de selección también prohíben que el electrón excitado caiga de nuevo a su estado básico (A), pero en cambio primero deben volver a B. Cuando los electrones en el nivel B se desexcitan a su estado fundamental, se produce la emisión de luz roja (fluorescencia) lo que da un brillo extra al color ya rojo causado por la absorción de las porciones amarillo-verde y violeta de la luz blanca.