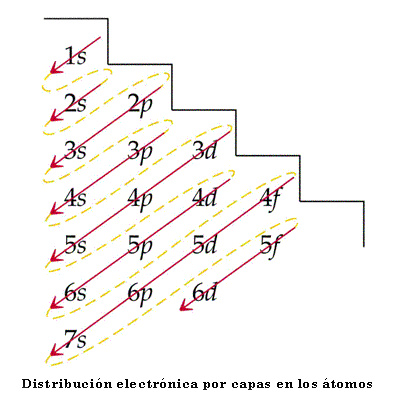
En los átomos, los electrones se organizan en capas alrededor del núcleo (capa 1, 2, 3, …), y cada capa puede contener distintos tipos de orbitales (s, p, d, f) que van siendo rellenados de forma ordenada por los electrones.
Las capas internas son las primeras que se rellenan de electrones, y sólo en las capas más externas pueden quedar orbitales incompletos, como por ejemplo donde se encuentran los “electrones de valencia” que participan en los enlaces químicos. Son los electrones de las capas más externas los que originan el color, concretamente cuando se encuentran “desapareados”, ya que esto favorece que se puedan producir transiciones electrónicas cuando interaccionan con la luz.
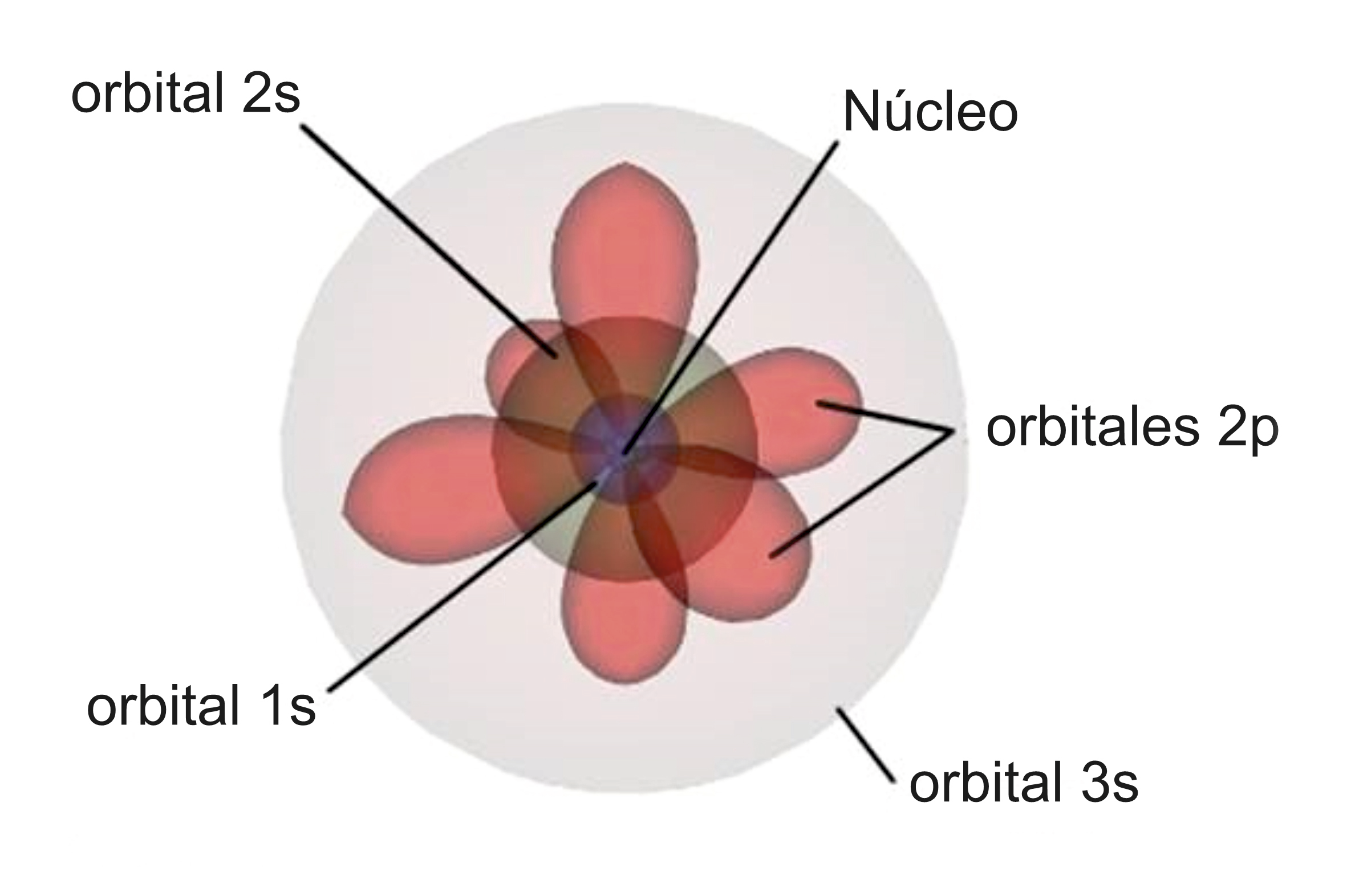
En ausencia de luz, cada átomo se encuentra en un estado de energía mínima posible (estado fundamental). Pero en presencia de luz, los átomos adquieren energías progresivamente más elevadas (estados excitados). Los estados de “energía permitidos” se pueden comparar con peldaños de alturas diferentes de una escalera. La luz o cualquier otra radiación únicamente puede ser absorbida en el caso de que la energía que transporta sea exactamente la necesaria para promocionar a un electrón de un peldaño de energía inferior hacia otro superior.