Los iones de los metales no de transición (alcalinos y alcalinotérreos) también pueden producir colores en ciertas circunstancias, como por ejemplo cuando se crean electrones desapareados debido a defectos cristalinos o a impurezas.
Éste es el caso de los centros de color o centros F (Farbzentren, en alemán) que consisten en un electrón atrapado en una región de un cristal iónico definida por el espacio creado cuando falta un ion (centro de color de "electrón") o cuando en un lugar donde normalmente hay un par de electrones falta uno de ellos (centro de color de “vacante").
Por ejemplo, cuando un cristal de fluorita CaF2 es sometido a una radiacción de alta energía o crece en presencia de exceso de calcio algunos iones de F- pueden perder su posición. Estas vacancias se rellenan con electrones arrancados de los iones cercanos, generando así centros de color. El electrón desapareado puede elevarse a niveles de energía más altos a través de la absorción de luz incidente como ocurría con los electrones desapareados de los iones de metales de transición.
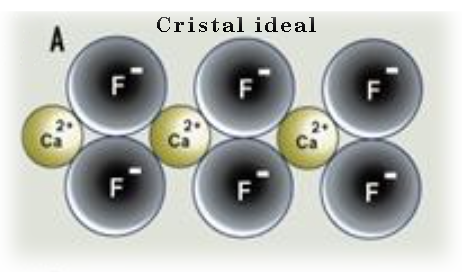
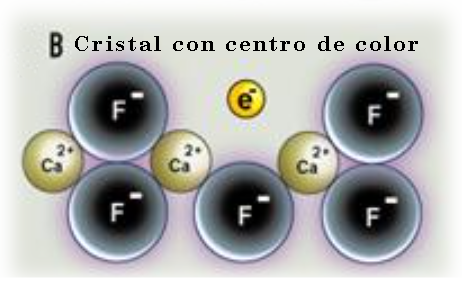
Centro de color de electrón en fluorita que origina su coloración.
