En un cristal metálico como el cobre, los electrones de valencia no ocupan orbitales concretos, sino que se agrupan con libertad para moverse por todo el cristal. Esta enorme movilidad (hay más de 1023 electrones por cm3) es la que le confiere a los metales una alta conductividad eléctrica y térmica, así como el brillo metálico y la reflexión especular.

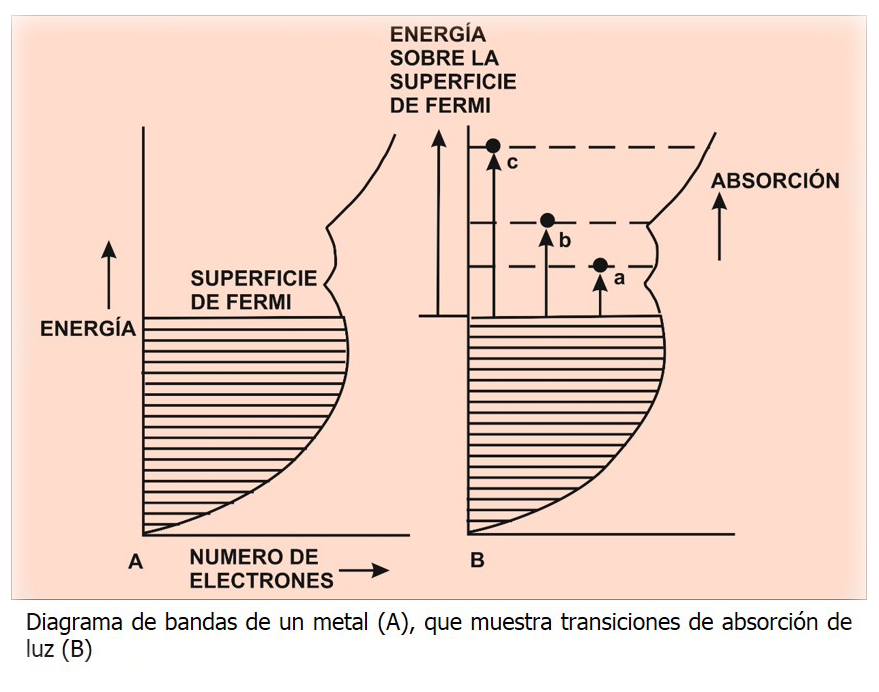
Como todos los electrones tienen libertad para intercambiarse entre sí, son esencialmente equivalentes (degenerados), es decir que pueden tener la misma energía. Pero como todos no caben en un mismo nivel energético, se agrupan en distintas bandas de energía, cada una con un número determinado de electrones. Estas bandas se disponen como un conjunto continuo, desde el estado fundamental hasta un máximo denominado "superficie de Fermi".


Cuando la luz incide sobre el metal, éste la absorbe por completo y los electrones excitados saltan desde la superficie de Fermi hasta los niveles energéticos superiores, que están vacíos. Inmediatamente, los electrones vuelven a su estado original reemitiendo la luz (brillo metálico). El color se emite cuando no toda la luz es devuelta, es decir, cuando el número de electrones de la banda superior es distinto al de la superficie de Fermi. Por tanto, es la forma de la banda sobre la superficie de Fermi la que determina los distintos colores de los metales o aleaciones (Cu, Ag, Au, bronce, etc).